有機化学の
可能性を
拡げよう
ライフサイエンスを加速する
技術開発を目指し、
有機合成化学に関する
研究に取り組んでいます。
特に、多彩な元素の特性を
活かした独自のアプローチで
新手法を開発しています。










2024/8/29
トップページを更新しました。
News
2024/1/10, 3/28, 4/1, 5/1,9, 7/5
トップページ・メンバー・研究成果・写真を更新しました。



私たちの研究成果が
Bulletin of the Chemical Society of Japan誌に掲載されました!
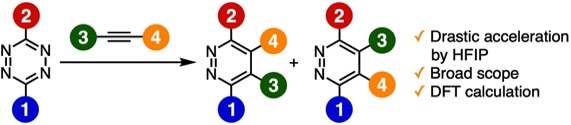
Pyridazine Synthesis from 1,2,4,5-Tetrazines and Alkynes in 1,1,1,3,3,3-Hexafluoro-2-propanol through the Inverse Electron Demand Diels–Alder Reaction
C. Yamamoto, M. Suzuki, S. Yoshida*
Bull. Chem. Soc. Jpn. 2022, 95, 1741.
(BCSJ award article)
テトラジン類を用いたアルキンとの反応は歴史ある反応ではありますが、効率的な反応条件の探索などについての研究例は乏しく、基質一般性もほとんど明らかにされていませんでした。これに対して、今回私たちはテトラジンとアルキンとの反応が1,1,1,3,3,3-ヘキサフルオロ-2-プロパノール(HIFP)を溶媒として用いることで効率的かつ高選択的に進行することを明らかにしました。本研究の基質一般性は広く、多彩なピリダジン類を合成できる手法です。さらに、DFT計算を利用することで、Diels–Alder反応と脱窒素を経る機構を明らかにするとともに、選択性等の予測にも役立つことを明らかにできました。
吉田がいくつかの記事を執筆しました。
有機合成化学協会誌 2022年11月号 p 898~
「ヒドロシランの活性化を利用した芳香族トリフルオロメチル基の選択的変換」
月刊「化学」2022年8月号 pp. 70–71【最新のトピックス】
「丈夫な結合をそっと変換する手法 −芳香族トリフルオロメチル基の選択的変換」
月刊「化学」2022年12月号 pp. 20–23【2022年ノーベル賞を読み解く】
「生体内で狙った分子だけを反応させる –生体直交化学とクリックケミストリーのめぐりあい」
「科学と工業」11月号(大阪工研協会)
「クリック反応を制御する新手法の開発」
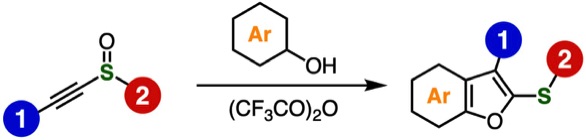
私たちの研究成果が RSC Advances 誌に掲載されました!
Synthesis of benzo[b]furans from alkynyl sulfoxides and phenols by the interrupted Pummerer reaction
A. Kobayashi, T. Matsuzawa, T. Hosoya, S. Yoshida*
RSC Adv. 2023, 13, 839.
アルキニルスルホキシドのPummerer型反応は未開拓な変換です。これに対して、今回私たちはアルキニルスルホキシドとフェノール類に対して、トリフルオロ酢酸無水物(TFAA)を作用させると、2位にチオ基を有する広範なベンゾフラン類を簡便合成できることを見いだしました。本反応の官能基許容性は高く、さまざまな多置換ベンゾフランを効率的に合成できます。生成物中のチオ基を足がかりとして、多彩なベンゾフラン類を合成できることから、生物活性化合物や有機材料等の開発に本手法が役立つと期待しています。
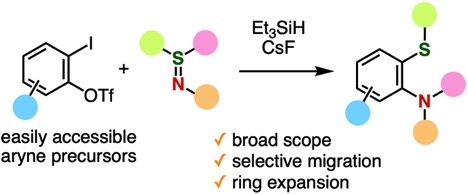
私たちの研究成果が Synlett 誌に掲載されました!
Migrative Thioamination of Aryne Intermediates Generated from o-Iodoaryl Triflates
S. Tabata, M. Minoshima, A. Kobayashi, T. Hosoya,
S. Yoshida*
Synlett 2023, 34, 1259.
アミノ基を有するジアリールスルフィド類は、生物活性化合物等として重要な化合物群です。これに対して、今回私たちはo-ヨードアリールトリフラート類をアライン前駆体として用いて、多彩なスルフィルイミンとの転位を伴ったチオアミノ化反応が進行することを明らかにしました。このとき、ヒドロシランとフッ化セシウムを活性化剤として用いたアライン発生法が効果的でした。本反応を利用することで、環拡大による中員環化合物合成にも成功しています。o-ヨードアリールトリフラート類が合成しやすいアライン前駆体であることから、本反応が広範なジアリールスルフィド合成に役立つと期待されます。
私たちの研究成果が The Chemical Record 誌に掲載されました!
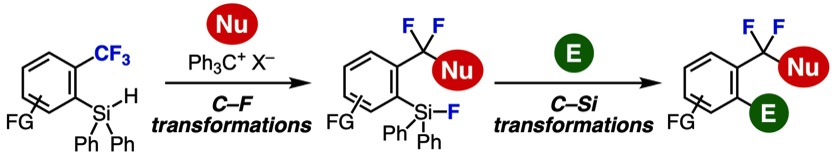
C−F Transformations of Benzotrifluorides by the Activation of ortho‐Hydrosilyl Group
S. Yoshida*
Chem. Rec. 2023, 23, e202200308.
オルト位に配置したヒドロシリル基の活性化を利用したトリフルオロメチル基の選択的変換に関するPersonal Accountです。有機フッ素化学に関する特集号において招待して頂き、フルオロ基を残したC–F変換に関するこれまでの研究成果について執筆いたしました。
私たちの研究成果が
Bulletin of the Chemical Society of Japan誌に掲載されました!
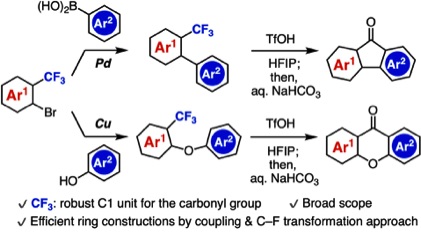
Synthesis of Fluorenones and Xanthones through Intramolecular C–F Arylation
S. Hamada, S. Yoshida*
Bull. Chem. Soc. Jpn. 2023, 96, 401.
C–F結合は強固で、有機合成化学の中でなかなか有効活用しやすい官能基ではありません。これに対して、今回私たちは1,1,1,3,3,3-ヘキサフルオロ-2-プロパノール(HIFP)を溶媒として用いてトリフルオロメタンスルホン酸を作用させる条件で環状ケトンを効率的に合成できることを明らかにしました。トリフルオロメチル基が特異な配向性を示す強固なC1ユニットであるため、これを利用した有機合成化学の発展につながる研究成果です。
2022/12/2(金) に開催された
第34回ケムステVシンポ『日本のクリックケミストリー』
の講演動画がYouTubeで公開されました!
「典型元素を活用したクリックケミストリーの新展開」
リン・硫黄などの典型元素の新しい可能性を引き出し、
クリックケミストリー制御のための新しい手法を開発しています。
私たちの研究成果が
Frontiers in Chemistry 誌に掲載されました!
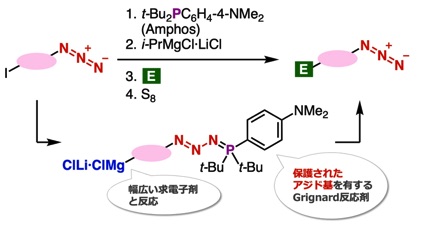
Synthesis of 1,2,3-triazoles using Grignard reactions through the protection of azides
R. Namioka, M. Suzuki, S. Yoshida*
Front. Chem. 2023, in press.
有機マグネシウム化合物は、有機合成において欠かせない合成中間体です。ただ、アジド基が損なわれてしまうため、アジド基を有する有機マグネシウム中間体は利用できませんでした。これに対して、今回私たちは、アジド基を持ったヨウ化アリールを用いて、Grignard反応を経て幅広い含窒素化合物を合成できることを明らかにしました。具体的には、私たちが以前に見いだした、有機リン化合物を利用した「アジド基保護法」を利用することで、ターボGrignard反応剤を用いたI–Mg交換がアジド基を損なわずに進行し、広範なアジド化合物を合成できることを明らかにしました。本手法とアルキンとのクリック反応を組み合わせて利用することで、多彩なトリアゾール類の合成にも成功しています。
本論文は、大嶋孝志先生@九大院薬がゲストエディターを務められている特集号に掲載されます。
私たちの研究成果が Organic & Biomolecular Chemistry
誌に掲載されました!
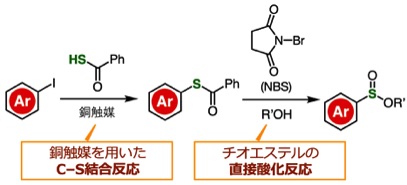
Facile synthesis of sulfinate esters from aryl iodides via direct oxidation of thioesters
K. Nakamura, Y. Kumagai, A. Kobayashi, M. Suzuki,
S. Yoshida*
Org. Biomol. Chem. 2023, 21, 6886.
チオエステルは、アシル基の電子求引性のため、チオールの豊富な反応性を抑えた化合物群であることから、チオールの保護体として用いられます。これに対して、今回私たちは、チオエステルの直接酸化によってスルフィン酸エステルを効率的に合成できることを見いだしました。幅広いチオエステル類を、ヨウ化アリールの銅触媒を用いるチオ化反応によって得られるため、多彩なスルフィン酸エステル類をヨウ化アリールから2工程で簡便合成できます。本手法は、最近私たちが精力的に開発している「スルフィン酸エステルの変換」の有用性を大きく向上させる原動力となります。
私たちの研究成果が New Journal of Chemistry
誌に掲載されました!
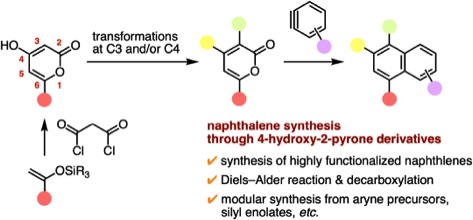
Multisubstituted naphthalene synthesis from 4-hydroxy-2-pyrones and o-silylaryl triflates
K. Numata, S. Tabata, A. Kobayashi, S. Yoshida*
New Journal of Chemistry 2023, 47, 18762.
多置換ナフタレンは幅広い研究分野で重要な化合物群ですが、その合成は決して容易ではありません。これに対して、今回私たちは、アラインと官能基化ピロンとの反応によって多置換ナフタレンを幅広く合成できることを明らかにしました。具体的には、4-ヒドロキシ-2-ピロン類を出発原料とすると多彩な官能基化ピロンを簡便合成できることから、これらと広範なアラインとの反応によって幅広い多置換ナフタレンの合成に成功しました。さらに、DFT計算による反応機構解明等にも成功しています。本手法を利用し、複雑芳香族化合物の新規合成法の開発に現在取り組んでいます!
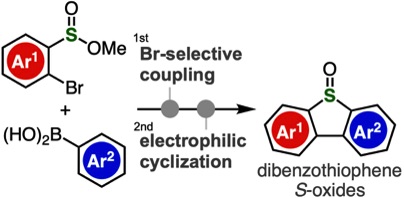
私たちの研究成果が Chemical Communications 誌に掲載されました!
Facile Synthesis of Dibenzothiophene S-Oxides from Sulfinate Esters
Y. Kumagai, A. Kobayashi, K. Nakamura, S. Yoshida*
Chem. Commun. 2024, 60, 1611.
スルホキシド部位を幅広い用途で利用できることから、ジベンゾチオフェンオキシドが有機合成化学・ケミカルバイオロジーなどにおいて注目を集めています。これに対して、今回私たちは、ブロモ基での選択的クロスカップリングとスルフィン酸エステルの活性化を経る環化反応によって多置換ジベンゾチオフェンオキシドを幅広く合成できることを明らかにしました。本手法では、ジベンゾチオフェンの酸化によって合成する従来法と比較して、本手法では、反応性に富んだ官能基を損なわずに骨格構築できる点が特長です。実際に、アライン発生部位として有用なo-シリルアリールトリフラート部位を有するジベンゾチオフェンオキシドの合成を達成できています。多置換ベンゾチオフェンオキシドを利用した応用研究などに現在取り組んでいます。
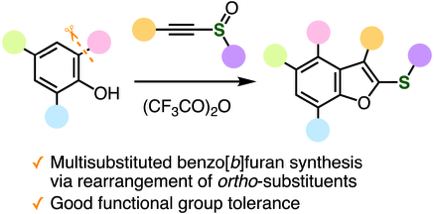
私たちの研究成果が Chemical Communications 誌に掲載されました!
Highly substituted benzo[b]furan synthesis through substituent migration
A. Kobayashi, S. Tabata, S. Yoshida*
Chem. Commun. 2024, 60, 4545. (Selected as ChemComm HOT Articles)
カチオン性中間体における転位を経た変換は、多数の置換基が密集した芳香族化合物を合成する稀有な手法として古くから注目されてきました。今回私たちは、ベンゼン環上の置換基の転位を経た多置換ベンゾフラン合成法を開発しました。最近開発した、アルキニルスルホキシドとフェノールを用いるベンゾフラン合成法に関して詳細に検討する中、オルト位に置換基を有するフェノールを用いたとき、ベンゼン環上の置換基の転位を経てベンゾフラン環が形成されることを見いだしました。この奇妙な変換を利用することで、五置換ベンゾフランを幅広く合成できます。さらに、2,3,5,6-テトラメチルフェノールを用いた場合には、置換基の2度の転位を経て、六置換ベンゾフランの合成にも成功しました。
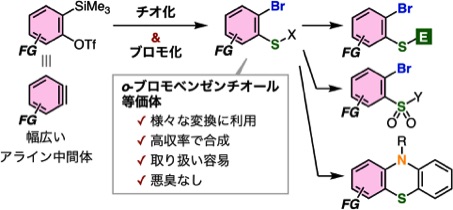
私たちの研究成果が Organic Letters 誌に掲載されました!
Bromothiolation of Arynes for the Synthesis of 2-Bromobenzenethiol Equivalents
S. Tabata, S. Yoshida*
Org. Lett. 2024, 26, 3816.
オルト位にブロモ基を有するベンゼンチオール類は、縮環型の含硫黄骨格を形成するために重要な化合物群ですが、幅広い官能基を有するo-ブロモベンゼンチオール類の合成は困難です。これに対して今回私たちは、アライン中間体にチオ基とブロモ基を一挙に導入できる反応を見いだし、オルト位にブロモ基を有するベンゼンチオール等価体を簡便合成できることを明らかにしました。具体的には、キサントゲン酸カリウムとブロモペンタフルオロベンゼン存在下、o-シリルアリールトリフラートにフッ化物イオンを作用させると、o-ブロモベンゼンチオール等価体の効率的な合成に成功しました。得られたベンゼンチオール等価体は、空気にも安定で、悪臭を伴わずにその後の合成に利用できる点が特徴です。実際に、本手法を利用することで、フェノチアジンやチアントレン類の合成に成功しています。
私たちの研究成果が Chemical Communications 誌に掲載されました!
Iterative click reactions using trivalent platforms for sequential molecular assembly
G. Orimoto, S. Yoshida*
Chem. Commun. 2024, 60, 4545.
信頼できる連結法を反復して分子鎖伸長する手法は、中分子量の生物活性化合物等の開発を支える重要な技術です。今回私たちは、クリック反応に利用できる3種類の官能基を併せ持ったプラットフォーム分子に対して、3種のクリック反応によって、部品(モジュール)となる広範な分子を集積できることを明らかにしました。このとき、どの反応も極めて官能基許容性・化学選択性高く進行する点が特徴です。さらに、適切なリンカーを用いることで、3種類のクリック反応の反復に成功し、高効率で分子鎖を伸長できることを明らかにしました。実際に、分子量1000を超える化合物であっても、入手・合成容易なモジュールの連結反応を繰り返すだけで簡便合成できることを明らかにできています。
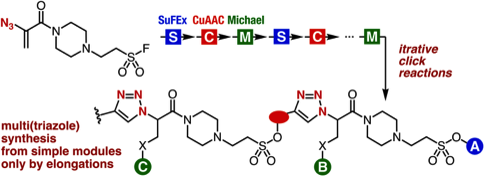
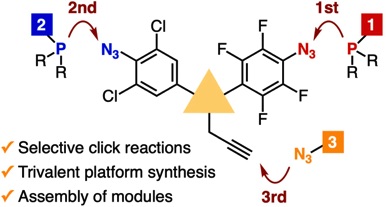
私たちの研究成果が Chemical Communications 誌に採択されました!
Click assembly through selective azaylide formation
M. Hamada, G. Orimoto, S. Yoshida*
Chem. Commun. 2024, 60, 7930.
分子を確実に連結するクリック反応を組み合わせ、3成分を効率的に集積する手法が、多機能性分子等の合成において注目されています。今回、私たちや他のグループが以前に開発した「強固なアザイリドを形成する手法」を組み込み、3度のクリック反応を高選択的に進行させる手法の開発に成功しました。具体的には、クロロ基やフルオロ基を有する芳香族アジド基を用いたトリアリールホスフィンとの反応における選択性を精査し、選択的なアザイリド形成を実現できることを明らかにしました。さらに、これら2種のアジド基と末端アルキンを併せ持ったプラットフォーム分子の開発に成功し、これを利用した高効率な3連続クリック反応が進行することを明らかにしました。
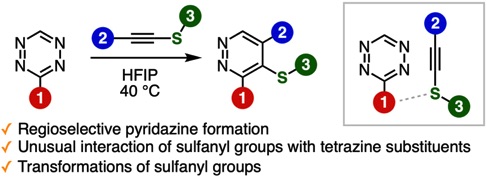
私たちの研究成果が Organic Chemistry Frontiers 誌に採択されました!
Regioselective pyridazine synthesis from tetrazines and alkynyl sulfides
C. Yamamoto, K. Numata, M. Suzuki, S. Yoshida*
Org. Chem. Front. 2024, in press; DOI: 10.1039/D4QO01286K
ピリダジン類は医農薬等の開発において有用な化合物群です。テトラジンとアルキンとのDiels–Alder反応と引き続く脱窒素を経る合成法は、古典的なピリダジン合成法のひとつですが、基質の構造が選択性に与える影響などに関する詳細な研究は行われていませんでした。これに対して、最近私たちは、テトラジンとアルキンとの反応の化学に改めて注目し、基質のデザイン、反応条件、計算化学等の先進的な知見を備えた研究に取り組んでいます。今回私たちは、硫黄官能基がこの反応の選択性を制御する重要な役割を果たすことを発見しました。硫黄官能基は幅広い変換にも利用できることから、多彩な三置換ピリダジンを合成する手法として役立つと期待されます。